Modelo atómico de Thomson
A finales del siglo XIX, los científicos empezaron a notar comportamientos en la materia que no se podían explicar mediante el modelo atómico propuesto por Dalton, como por ejemplo el experimeto realizado por Millikan a mediados del siglo XIX, el cuál consistió en dejar caer una gota de aceite a través de un campo eléctrico en un tubo cerrado al vacío, el cual determinó que la carga mínima que adquiría la gota de aceite era igual a 1,6x10-19 C, la que junto a otras experiencias de carácter electromagnético daban la idea de que el modelo "esférico indivisible" propuesto por Dalton estaba errado y que había alguna partícula cargada que pudiera ser afectada por cambios en el campo eléctrico.
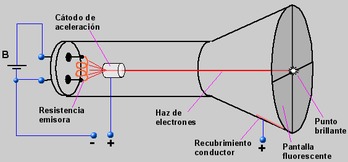
Tras estos descubrimientos, los científicos empezaron a tratar de darle una explicación a estos fenómenos. La más importante fue la realizada por Thomson a finales del siglo XIX e inicios del XX, la cual consistió en la utilización de un tubo llamado "tubo de rayos catódicos" (Imagen MAT-1), el cual consistía en dos electrodos unidos a una fuente de alto voltaje, conectados en un tubo cerrado al vacío. Al hacer pasar corriente eléctrica desde la fuente de poder al ánodo (electrodo negativo) se veía que un haz luminoso se dirigía desde el ánodo hacia el cátodo (electrodo positivo). A este rayo se le llamó rayo catódico y fue el estudiado por Thomson, el cuál sometió a este rayo a un campo electromagnético, observando que el rayo se desviaba de su línea recta hacia el extremo positivo del campo, lo que sumado al conocimiento de que cargas opuestas se atraen le dio como conclusión que el rayo catódico estaba compuesto por partículas negativas provenientes del ánodo, a las cuales les llamó electrones. Tras este descubrimiento, Thomson formuló un nuevo modelo atómico que fue denominado "pastel de pasas" (representado aproximadamente en la Imagen MAT-2), el cuál consistía en que los electrones se encontraban incrustados en una esfera cargada positivamente con la misma intensidad de carga (ésta fue la primera vez que se propuso la electro-neutralidad del átomo), además Thomson pudo establecer que la razón entre carga del electrón (que fue descubierta por Millikan, explicado anteriormente) y su masa era igual a 1,756x108.
Imagen MAT-2: Las esferas blancas representan a los electrones y la esfera roja representa la partícula positiva.